2026-10-14
據中國科學院消息,“面向空間應用的鋰離子電池電化學光學原位研究”項目已在中國空間站內開展,神舟二十一號航天員乘組共同在軌操作該項目實驗,中國科學院研究員張洪章作為載荷專家發揮了其專業優勢。

圖源:央視新聞
鋰離子電池是現代航天任務的“能量心臟”,具有能量密度高、循環壽命長、安全可靠等優點。然而,在地面實驗中,很難單獨研究重力對電池內部過程的影響。太空的微重力環境,為突破這一難題提供了獨特條件。
據悉,本次鋰離子電池上行實驗的推進,有望突破重力場與電場耦合作用的認知瓶頸,推動電化學基礎理論的進一步發展,為優化目前在軌電池系統、設計下一代高比能高安全太空電池提供依據。
最佳電極元素——鋰
鋰是一種金屬元素,位于元素周期表第二周期IA族,元素符號為Li,被譽為綠色能源金屬和“白色石油”,廣泛應用于儲能、化工、電子工業等領域。
遇水會“燃燒”的鋰
鋰遇水會發生化學反應,向水分子輸送電子,最后會起火燃燒。化學反應式為:
2Li + 2H2O → 2LiOH + H2

圖源:《圖解中學化學》
鋰是智能手機、筆記本電腦及電動汽車等產品不可缺少的元素,它們使用的電池都是鋰離子電池。

圖源:維基百科,作者 MyXyloto
鋰離子電池是一種二次電池(蓄電池),可以反復充電,長期使用。放電時,鋰離子從負極向正極移動,從而產生電流。離子是指原子失去或得到電子而處于帶正電或負電的狀態。從外部向電池加電壓(充電)時,移到正極的鋰離子可返回負極,再次處于可放電的狀態。
電池主要利用負極材料與正極材料“釋放電子的難易程度差異”來產生電。容易釋放電子的材料用作負極,容易接收電子的材料用作正極。負極釋放電子的難度與正極接收電子的難度差異越大,電池的動力(電壓)越大。
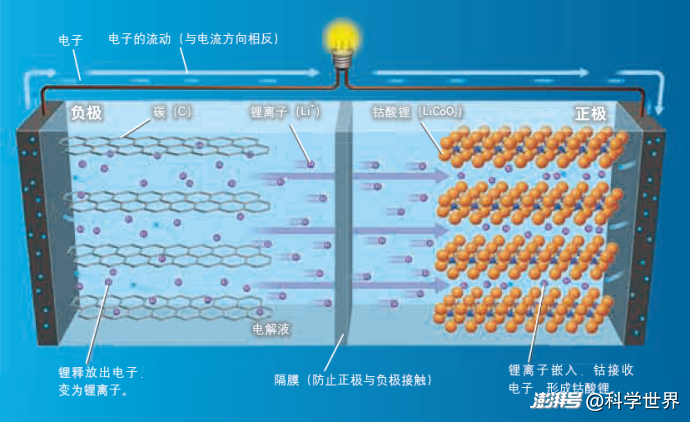
鋰離子電池的工作原理(圖源:《科學世界》2016年第12期)
鋰離子電池主要依靠鋰離子(Li+)從負極移到正極來產生電。最初,鋰嵌在負極層狀碳的空隙中。用導線連接正負極后,鋰釋放出電子,變成鋰離子,穿過隔膜向正極移動,在正極被層狀結構的鈷酸鋰“捕獲”。充電時的反應與此完全相反。 鋰本身不用作負極材料,但是其混在碳中,實質上起到了負極的作用。
釋放電子的難易程度(離子化傾向)取決于元素的種類。鋰是所有元素中最容易釋放電子(離子化傾向大)的元素,用作電池負極時,電壓最高。此外,鋰還是最輕的金屬元素,原子較小,是實現電池小型化與輕便化的最佳元素。
除了鋰元素,智能手機中還使用了很多金屬元素,例如揚聲器中使用的釹(Nd)、液晶屏中必不可少的銦(In)等。以手機為代表的家電產品中滿是化學元素,我們的生活正是因為巧妙地利用了化學才獲得可持續發展。
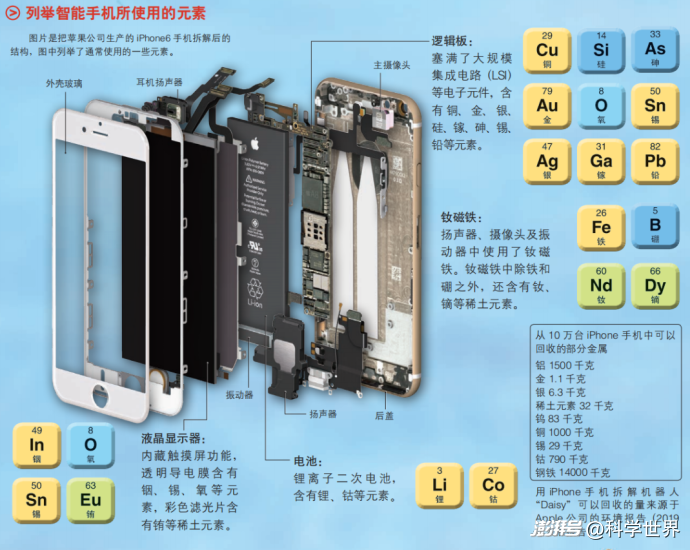
圖源:《圖解中學化學》
其實化學不只存在于實驗室或者教科書里,我們的生活也和化學息息相關:它存在于廚房的調料中;存在于超市的貨架上;存在于家中的電器里......
想了解更多身邊的化學小知識嗎?那這本《圖解中學化學》你一定不能錯過!

特別聲明